Thu hồi 11 thuốc chứa Ranitidine có tạp chất vượt ngưỡng quy định
Cục Quản lý Dược cho biết, căn cứ vào các quy chế dược hiện hành của Việt Nam; căn cứ thông báo của Cơ quan Khoa học y tế Singapore (HSA), Cơ quan quản lý dược phẩm Thụy Sĩ (Swissmedic) về việc thu hồi các thuốc chứa Ranitidine do phát hiện chứa tạp chất N-nitrosodimethylamine (NDMA) có nguy cơ gây ung thư ở hàm lượng vượt quá ngưỡng cho phép của quốc tế.
Để đảm bảo an toàn cho người sử dụng, Cục Quản lý Dược yêu cầu thu hồi tất cả các thuốc thành phẩm có tên sau đây:
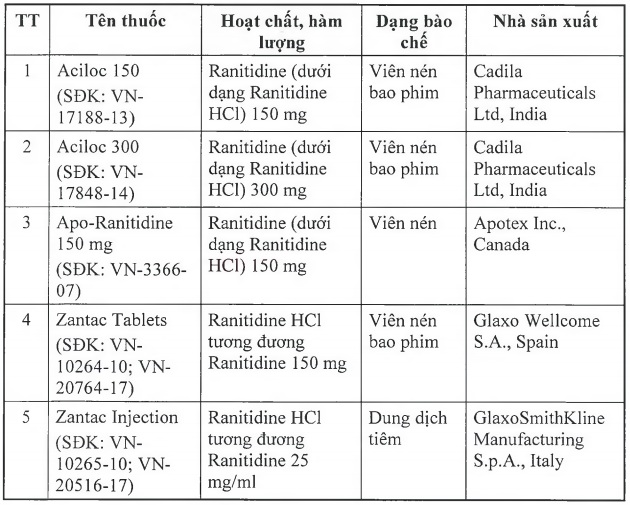

Cục Quản lý Dược yêu cầu các Công ty nhập khẩu thuốc phối hợp với nhà phân phối thuốc thông báo thu hồi tất cả các lô thuốc thành phấm nêu trên tới các cơ sở bán buôn, bán lẻ, sử dụng thuốc và tiến hành thu hồi toàn bộ các lô thuốc này. Gửi báo cáo thu hồi về Cục Quản lý Dược trong vòng 01 tháng kể từ ngày ký Công văn này, hồ sơ thu hồi bao gồm số lượng nhập khẩu, số lượng thu hồi, các bằng chứng về việc thực hiện thu hồi tại các cơ sở bán buôn, bán lẻ, sử dụng đã mua thuốc theo quy định tại Thông tư số 11/2018/TT-BYT ngày 04/5/2018 của Bộ Y tế quy định về chất lượng thuốc, nguyên liệu làm thuốc.
Đề nghị Sở Y tế các tỉnh, thành phố thông báo việc thu hồi tới các cơ sở kinh doanh, sử dụng thuốc trên địa bàn. Công bố thông tin việc thu hồi tất cả các thuốc thành phẩm nêu trên trên Trang thông tin điện tử của Sở. Kiểm tra và giám sát các Công ty nhập khẩu thuốc trên địa bàn thục hiện việc thu hồi các thuốc nêu trên.
Trước đó, Cục Quản lý Dược cũng đã có văn bản về việc phát hiện thuốc chứa Ranitidine có chứa tạp chất NDMA vượt giới hạn cho phép và yêu cầu các cơ sở sản xuất thuốc chứa dược chất Ranitidine chỉ được đưa vào sản xuất thuốc các lô nguyên liệu dược chất Ranitidine không có tạp chất NDMA. Trường hợp lô nguyên liệu dược chất Ranitidine có tạp chất NDMA thì không được vượt quá giới hạn cho phép của tạp chất NDMA theo giới hạn chấp nhận quy định tại ICH M7.
Cụ thể: Giới hạn NDMA tạm thời chấp nhận không quá 0.32 ppm (tính trên liều chấp nhận tối đa của NDMA là 96 nanogram/ngày và liều sử dụng tối đa của Ranitidine là 300mg/ngày).
Đồng thời, thực hiện đánh giá và kiểm soát chặt chẽ cơ sở cung ứng nguyên liệu, nguồn gốc nguyên liệu. Kiểm tra chất lượng từng lô nguyên liệu dược chất Ranitidine theo quy định và phân tích bổ sung chỉ tiêu đối với tạp chất NDMA.
Cục Quản lý Dược yêu cầu các cơ sở nhập khẩu thuốc, nguyên liệu dược chất Ranitidine thực hiện nghiêm túc việc đánh giá cơ sở cung cấp, cơ sở sản xuất nguyên liệu, cơ sở sản xuất thuốc thành phẩm. Cơ sở nhập khẩu nguyên liệu chỉ nhập khẩu các lô nguyên liệu Ranitidine đạt tiêu chuẩn chất lượng theo tiêu chuẩn đã được chấp nhận, đồng thời không có hoặc không vượt quá giới hạn cho phép các tạp chất NDMA. Cơ sở nhập khẩu chịu trách nhiệm lưu trữ các bằng chứng chứng minh lô nguyên liệu nhập khấu đáp ứng yêu cầu trên.
Thuốc chứa Ranitidine có tạp chất NDMA vượt giới hạn cho phép gây nguy hiểm cho sức khỏe người bệnh. Ảnh minh họa
Cơ sở nhập khẩu thuốc phải phối hợp với cơ sở sản xuất thuốc nuớc ngoài đảm bảo thuốc chứa dược chất Ranitidine được sản xuất từ nguồn nguyên liệu không có hoặc không vượt quá giới hạn tạp chất NDMA. Cơ sở nhập khẩu thuốc chịu trách nhiệm về việc lưu trữ các bằng chứng chứng minh từng lô thuốc nhập khấu đạt tiêu chuẩn chất lượng và được sản xuất từ lô nguyên liệu dược chất Ranitidine đáp ứng yêu cầu nêu trên.
Đề nghị Viện Kiểm nghiệm thuốc Trung ương, Viện Kiểm nghiệm thuốc TP.Hồ Chí Minh nghiên cứu, triển khai và hướng dẫn các Trung tâm kiểm nghiệm tỉnh, thành phố thực hiện quy trình phân tích xác định tạp chất NDMA trong nguyên liệu và trong thuốc chứa dược chất Ranitidine. Tăng cường lấy mẫu để kiểm tra chất lượng nguyên liệu và thuốc chứa dược chất Ranitidine tại cơ sở nhập khẩu và cơ sở sản xuất thuốc, và ưu tiên phân tích bổ sung xác định tạp chất NDMA trong mẫu đã lấy. Báo cáo kịp thời tới Cục Quản lý Dược về kết quả kiểm tra chất lượng nguyên liệu và thuốc chứa dược chất Ranitidine nêu trên để Cục Quản lý Dược có căn cứ xử lý tiếp theo.
