- Bầu cử Tổng thống Mỹ 2024
- Nhìn lại Hội nghị Thủ tướng đối thoại với nông dân 2023
- Chủ tịch Hội NDVN- Bộ trưởng TNMT lắng nghe nông dân nói
- Kỷ nguyên mới - Kỷ nguyên vươn mình
- Tháo gỡ điểm nghẽn thể chế
- Kỳ họp thứ 8 Quốc hội khóa XV
- Căng thẳng Triều Tiên - Hàn Quốc đang gia tăng
- Diễn đàn Nông dân quốc gia lần thứ IX - 2024
Chủ đề nóng
- Đăng nhập
- Đăng ký
- ×
Vui lòng đăng nhập hoặc đăng ký để gửi bình luận
Khi nhấn đăng nhập đồng nghĩa với việc bạn đã đồng ý với điều khoản sử dụng của báo Dân Việt
Đăng nhập
Họ và tên
Mật khẩu
Mã xác nhận

Khi nhấn đăng ký đồng nghĩa với việc bạn đã đồng ý với
điều khoản sử dụng của
báo Dân Việt
Đăng ký
Xin chào, !
Bạn đã đăng nhập với email:
Đăng xuất
Tiếp tục gia hạn giấy đăng ký lưu hành cho 32 vaccine, sinh phẩm
Diệu Linh
Chủ nhật, ngày 19/06/2022 09:38 AM (GMT+7)
Cục Quản lý Dược (Bộ Y tế) vừa có quyết định ban hành danh mục 32 vaccine, sinh phẩm được cấp, gia hạn giấy đăng ký lưu hành tại Việt Nam
Bình luận
0
Theo Cục Quản lý Dược, 32 vaccine, sinh phẩm được cấp, gia hạn giấy đăng ký lưu hành tại Việt Nam, bao gồm:
5 sinh phẩm được cấp giấy đăng ký lưu hành có số đăng ký với ký hiệu SP3-…-22, hiệu lực 3 năm kể từ ngày 17/6;
3 vaccine được gia hạn giấy đăng ký lưu hành hiệu lực 5 năm. Theo Cục Quản lý Dược, các vaccine này được giữ nguyên thông tin số đăng ký đã được cấp;
4 sinh phẩm được gia hạn giấy đăng ký lưu hành hiệu lực 3 năm. Cục Quản lý Dược nêu rõ, các sinh phẩm này được giữ nguyên thông tin số đăng ký đã được cấp;
20 sinh phẩm được gia hạn giấy đăng ký lưu hành hiệu lực 5 năm. Các sinh phẩm này được giữ nguyên thông tin số đăng ký đã được cấp.
Tại quyết định, Cục Quản lý Dược nêu rõ, cơ sở sản xuất và cơ sở đăng ký thuốc có trách nhiệm sản xuất, cung cấp thuốc vào Việt Nam theo đúng các hồ sơ, tài liệu đã đăng ký với Bộ Y tế và phải in số đăng ký được Bộ Y tế Việt Nam cấp lên nhãn thuốc.
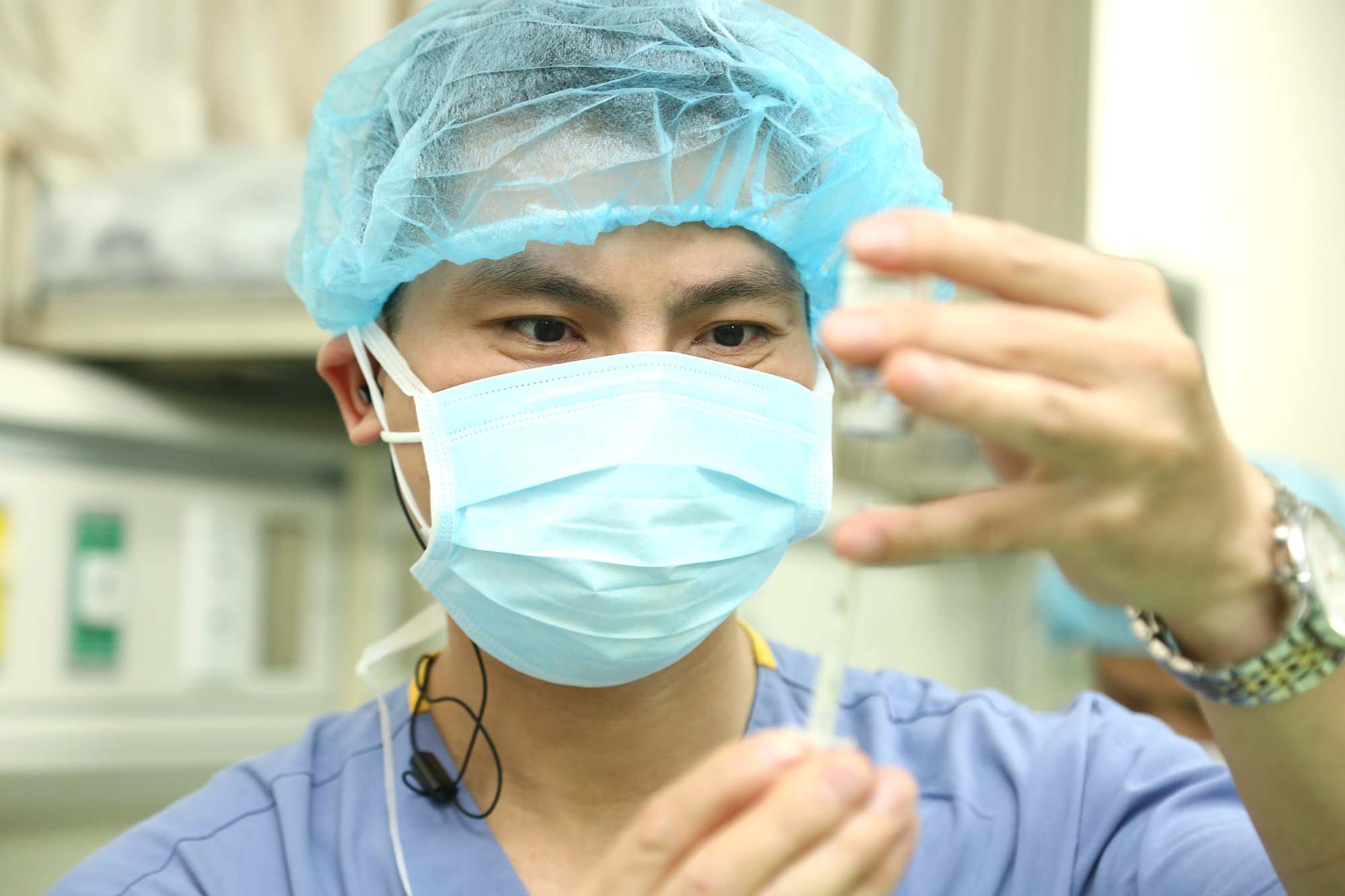
32 vaccine, sinh phẩm được cấp, gia hạn giấy đăng ký lưu hành tại Việt Nam (Tiêm vaccine Covid-19 tại Bệnh viện Việt Đức. Ảnh BVCC)
Chấp hành đầy đủ pháp luật của Việt Nam và các quy định của Bộ Y tế về sản xuất, nhập khẩu thuốc và lưu hành thuốc tại Việt Nam, nếu có bất cứ thay đổi gì trong quá trình lưu hành thuốc ở nước sở tại và ở Việt Nam thì phải báo cáo ngay cho Cục Quản lý Dược - Bộ Y tế.
Thực hiện việc cập nhật tiêu chuẩn chất lượng của thuốc theo quy định tại Thông tư số 11/2018/TT-BYT của Bộ trưởng Bộ Y tế quy định về chất lượng thuốc, nguyên liệu làm thuốc; Cập nhật nhãn thuốc và tờ hướng dẫn sử dụng thuốc theo quy định tại Thông tư số 01/2018/TT-BYT của Bộ trưởng Bộ Y tế quy định ghi nhãn thuốc, nguyên liệu làm thuốc và tờ hướng dẫn sử dụng thuốc trong thời hạn 6 tháng kể từ ngày 17/6 theo hình thức thay đổi, bổ sung giấy đăng ký lưu hành thuốc quy định tại Thông tư số 32/2018/TT-BYT Bộ trưởng Bộ Y tế quy định việc đăng ký lưu hành thuốc, nguyên liệu làm thuốc.
Trước đó, Cục Quản lý Dược (Bộ Y tế) cũng đã gia hạn giấy đăng ký lưu hành cho 6.251 thuốc, nguyên liệu làm thuốc nước ngoài; thuốc, nguyên liệu sản xuất trong nước, vaccine và sinh phẩm y tế. Bao gồm: 4.631 thuốc sản xuất trong nước, 1.427 thuốc nước ngoài và 193 vaccine, sinh phẩm y tế hết hạn trước 30/6/2022.
Cục Quản lý Dược nêu rõ, danh mục hơn 6.251 thuốc, vaccine và sinh phẩm y tế này thuộc nhóm hết hạn đăng ký lưu hành từ ngày 30/12/2021 đến trước 30/6/2022.
Các thuốc khác đáp ứng yêu cầu tại Nghị định số 29/2022/NĐ-CP đang được tiếp tục cập nhật, bổ sung tại các đợt công bố tiếp theo.
Các thuốc điều trị được gia hạn thuộc nhiều chuyên khoa khác nhau như thuốc điều trị bệnh đường hô hấp, dạ dày, kháng sinh, thuốc hạ sốt giảm đau... Danh mục thuốc được đăng tải trên Cổng thông tin điện tử của Bộ Y tế và Cục Quản lý Dược.
Việc chậm trễ ra hạn hàng nghìn loại thuốc, sinh phẩm y tế trong thời gian qua là 1 trong những nguyên nhân gây chậm đấu thầu thuốc, gây thiếu thuốc tại nhiều cơ sở y tế trong thời gian qua.
Giải thích việc chậm gia hạn đăng ký thuốc, đại diện Cục Quản lý dược, Bộ Y tế cho biết các hồ sơ đăng ký thuốc sắp hết hạn nêu trên do dịch Covid-19 kéo dài khiến nhiều doanh nghiệp, tổ chức phải làm việc giãn cách, gây ảnh hưởng đến các hoạt động.
Cùng với đó, các đơn vị đăng ký thuốc đến hạn phải cập nhật hồ sơ, dữ liệu (trong đó có yêu cầu về giấy chứng nhận thuốc) để xét cấp lại số đăng ký, nhưng đã không thể hoàn thành.
Ngoài ra, đối với việc xem xét cấp phép các thuốc điều trị Covid-19 do mới được nghiên cứu, phát triển trong thời gian ngắn, chưa có thời gian để thu thập được đầy đủ dữ liệu nên đã có những khó khăn nhất định trong việc xem xét, cấp phép theo các quy định hiện hành.
Mời các bạn đồng hành cùng báo Dân Việt trên mạng xã hội Facebook để nhanh chóng cập nhật những tin tức mới và chính xác nhất.
Tin cùng chuyên mục
Xem theo ngày
Xem
Tin nổi bật








Vui lòng nhập nội dung bình luận.