- Giá vàng liên tục lập đỉnh
- Kết luận điều tra vụ Tập đoàn Phúc Sơn
- Đề án bồi dưỡng cán bộ hội nông dân, nông dân xuất sắc
- MV Bắc Bling của Hòa Minzy khuấy đảo mạng xã hội
- Sáp nhập tỉnh - đột phá để phát triển
- Đưa Nghị quyết 57 vào cuộc sống
- Mô hình chính quyền ba cấp
- Kỳ họp bất thường thứ 9 Quốc hội khóa XV
- Giá vàng liên tục lập đỉnh
- Kết luận điều tra vụ Tập đoàn Phúc Sơn
- Đề án bồi dưỡng cán bộ hội nông dân, nông dân xuất sắc
- MV Bắc Bling của Hòa Minzy khuấy đảo mạng xã hội
- Sáp nhập tỉnh - đột phá để phát triển
- Đưa Nghị quyết 57 vào cuộc sống
- Mô hình chính quyền ba cấp
- Kỳ họp bất thường thứ 9 Quốc hội khóa XV
- Giá vàng liên tục lập đỉnh
- Kết luận điều tra vụ Tập đoàn Phúc Sơn
- Đề án bồi dưỡng cán bộ hội nông dân, nông dân xuất sắc
- MV Bắc Bling của Hòa Minzy khuấy đảo mạng xã hội
- Sáp nhập tỉnh - đột phá để phát triển
- Đưa Nghị quyết 57 vào cuộc sống
- Mô hình chính quyền ba cấp
- Kỳ họp bất thường thứ 9 Quốc hội khóa XV
Chủ đề nóng
- Đăng nhập
- Đăng ký
- ×
Vui lòng đăng nhập hoặc đăng ký để gửi bình luận
Khi nhấn đăng nhập đồng nghĩa với việc bạn đã đồng ý với điều khoản sử dụng của báo Dân Việt
Đăng nhập
Họ và tên
Mật khẩu
Mã xác nhận

Khi nhấn đăng ký đồng nghĩa với việc bạn đã đồng ý với
điều khoản sử dụng của
báo Dân Việt
Đăng ký
Xin chào, !
Bạn đã đăng nhập với email:
Đăng xuất
Xem xét, đánh giá kết quả thử nghiệm giai đoạn 3a vắc xin Covid-19 Nano Covax
Diệu Linh
Thứ hai, ngày 23/08/2021 11:48 AM (GMT+7)
Theo nhóm nghiên cứu, kết quả thử nghiệm lâm sàng vắc xin Covid-19 Nano Covax giai đoạn 3a cho thấy vắc xin đảm bảo tính an toàn và tính sinh miễn dịch.
Bình luận
0
Ngày 23/8, một đại diện nhóm nghiên cứu cho biết, Bộ Y tế sẽ thông báo kết luận thẩm định của Hội đồng Đạo đức về kết quả thử nghiệm lâm sàng vắc xin Covid-19 Nano Covax giai đoạn 3a "trong thời gian sớm nhất".
Trước đó, ngày 22/8, Hội đồng Đạo đức trong nghiên cứu y sinh, Bộ Y tế đã họp đánh giá, xem xét để thông qua kết quả thử nghiệm lâm sàng giữa kỳ giai đoạn 3a đối với vắc xin Covid-19 Nano Covax của Công ty Nanogen.
Theo báo cáo của nhóm nghiên cứu, giai đoạn 3a thử nghiệm trên 1.004 tình nguyện viên ở Hà Nội và Long An. Đây là nghiên cứu ngẫu nhiên, mù đôi, có đối chứng giả dược với tỉ lệ 6:1 (6 người tiêm vắc-xin Nano Cova 1 người tiêm giả dược). Các tình nguyện viên bắt đầu tiêm mũi 1 từ ngày 8/6, sau 28 ngày tiêm mũi 2 và kết thúc theo dõi vào đầu tháng 6/2022.
Nghiên cứu ở giai đoạn này cho phép các tình nguyện viên có tiền sử dị ứng, bệnh tim mạn tính, đái tháo đường, tăng huyết áp, từng mắc ung thư, người béo phì… tham gia với tổng 162 người.
Có 988 người tiêm đủ 2 mũi. Trong đó, 925 người có đủ dữ liệu đánh giá ở thời điểm ngày thứ 42. Kết quả cho thấy vắc-xin Nano Covax đạt yêu cầu về tính an toàn.
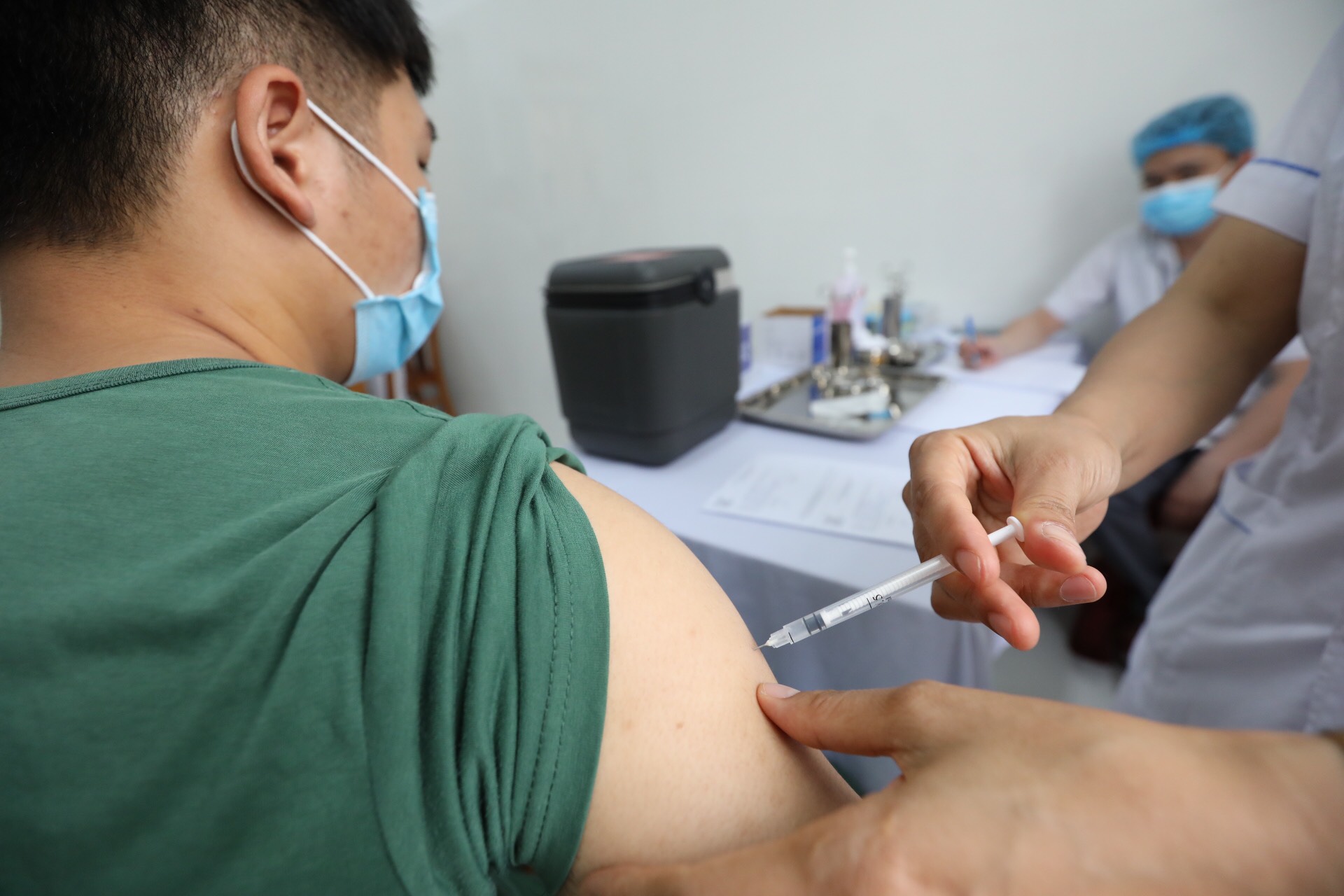
Thử nghiệm vắc xin Covid-19 Nano Covax. Ảnh BYT
Theo báo cáo, khoảng 20-25% tình nguyện viên bị mệt mỏi mức độ nhẹ sau tiêm vắc xin, tỉ lệ này ở nhóm giả dược từ 23-29%; mệt mỏi mức độ trung bình khá thấp, dao động 1,2-1,9% so với 0,7-2,9% ở nhóm giả dược. 29 trường hợp bị tiêu chảy mức độ nhẹ sau tiêm vắc xin mũi 1 và 27 trường hợp sau tiêm mũi 2, chiếm tỉ lệ lần lượt 3,4% và 3,3%; 2 trường hợp bị tiêu chảy mức độ trung bình.
Tỉ lệ bị sốt sau tiêm vắc xin dao động 2,3-3,7% bị sốt nhẹ, 0,2% sốt trung bình, 0,1% sốt nặng. Ở nhóm giả dược, nhóm sốt nhẹ dao động từ 1,4-4,8%. Cũng theo báo cáo, 14 trường hợp gặp biến cố bất lợi trong quá trình tham gia thử nghiệm. Tuy nhiên, 11 trường hợp không liên quan vắc-xin.
Có 3 trường hợp gặp biến cố bất lợi sau tiêm, đã hồi phục hoàn toàn, trong đó 1 ca chưa kết luận được mức độ liên quan do bị phổi tắc nghẽn mạn tính; 2 trường hợp bị phản vệ độ 2, sau xử trí đều đã hồi phục hoàn toàn.
Đánh giá giữa kỳ giai đoạn 3a cho thấy vắc xin Nano Covax có tỉ lệ chuyển đổi huyết thanh lên tới 99,2% ở ngày thứ 42. Kết quả đánh giá hiệu giá kháng thể trung hoà virus bằng phương pháp PRNT50 của những người đã tiêm vắc xin Nano Covax cho thấy ở thời điểm ngày thứ 42 sau tiêm mũi 1 và là ngày 14 sau tiêm mũi 2, tỉ lệ có khả năng trung hoà virus sống là 96,5%.
Trung bình nhân hiệu giá kháng thể PRNT50 với chủng Vũ Hán là 63,5 trong khi ở nhóm giả dược là 5. PRT50 được coi là "tiêu chuẩn vàng" để phát hiện và đo lường các kháng thể có khả năng vô hiệu hóa virus hay không. Trong phòng thí nghiệm, máu của người tiêm vắc xin sẽ được pha loãng, trộn chung với virus sống để đánh giá hiệu quả bảo vệ của vắc xin.
Gộp chung giai đoạn 2 và 3a, nhóm nghiên cứu kết luận trung bình nhân nồng độ kháng thể Anti-S-IgG đạt 57.56 U/ml, tăng gấp 218,93 lần sau 42 ngày tiêm vắc-xin. Tỉ lệ chuyển đổi huyết thanh đạt 99,2%
Với kết quả này, nhóm nghiên cứu kết luận vắc xin Covid-19 Nano Covax đạt yêu cầu về tính sinh miễn dịch, từ đó kiến nghị tiếp tục thực hiện nghiên cứu pha 3b trên 12.000 tình nguyện viên đảm bảo an toàn, đúng tiến độ và đề xuất các cơ quan chuyên môn xem xét cấp phép khẩn cấp có điều kiện cho vắc xin Nan Covax.
Đến thời điểm hiện tại, Nano Covax là vắc xin Covid-19 đầu tiên của Việt Nam đang thử nghiệm lâm sàng giai đoạn thứ 3. Sau hơn 8 tháng tiến hành 3 giai đoạn thử nghiệm lâm sàng vắc xin Nano Covax, đã có gần 14.000 người được tiêm thử nghiệm.
Theo Thông tư số 11/2021/TT-BYT về Hướng dẫn đăng ký lưu hành vắc xin Covid-19 trong trường hợp cấp bách, Bộ Y tế vừa ban hành, vắc xin Covid-19 trong nước đang thử nghiệm lâm sàng được xem xét cấp giấy đăng ký lưu hành có điều kiện khi đã có kết quả đánh giá giữa kỳ giai đoạn 3 về tính an toàn và hiệu quả bảo vệ của vắc-xin, dựa trên dữ liệu về tính sinh miễn dịch của vắc xin.
Việc này được thực hiện trên cơ sở ý kiến tư vấn của Hội đồng Đạo đức trong nghiên cứu y sinh học cấp quốc gia đối với thực hiện thử nghiệm lâm sàng tại Việt Nam và ý kiến tư vấn của Hội đồng Tư vấn cấp giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc đối với từng vắc xin cụ thể, có tham khảo hướng dẫn hoặc khuyến cáo của Tổ chức Y tế Thế giới (WHO).
Vắc xin sẽ được cấp giấy đăng ký lưu hành trong vòng 20 ngày làm việc kể từ khi nhận đủ hồ sơ. Sau khi được cấp phép, các bên liên quan phải tiếp tục theo dõi về tính an toàn, hiệu quả, kiểm soát về đối tượng, số lượng, phạm vi sử dụng; tiếp tục nghiên cứu và cập nhật dữ liệu lâm sàng theo hướng dẫn của Bộ Y tế.
Tại Việt Nam hiện có 3 vắc-xin Covid-19 đang thử nghiệm lâm sàng, gồm 2 vắc-xin được sản xuất trong nước là Nano Covax đang thử nghiệm giai đoạn 3, vắc-xin Covivac vừa bước vào thử nghiệm lâm sàng giai đoạn 2; vắc-xin Arct-154 - là vắc-xin được Mỹ chuyển giao công nghệ vừa thử nghiệm lâm sàng giai đoạn 1.
Khuyến cáo phòng dịch Covid-19 của Bộ Y tế. Ảnh BYT
Tin cùng chủ đề: Tin mới nhất về vaccine Covid-19
- Việt Nam sẽ tiếp tục nhận được vaccine Covid-19 của Mỹ qua cơ chế COVAX
- Tiêm vaccine phòng Covid-19 không đúng đối tượng, Giám đốc Trung tâm Y tế bị cách chức
- Kỷ luật Chủ tịch xã mời 20 người thân cán bộ tiêm vaccine sai quy định
- Vụ cô gái khoe tiêm 2 mũi vaccine nhờ "xin ông anh" ở Cần Thơ: Thông tin mới từ lãnh đạo quận
Mời các bạn đồng hành cùng báo Dân Việt trên mạng xã hội Facebook để nhanh chóng cập nhật những tin tức mới và chính xác nhất.
Tin cùng chuyên mục
Xem theo ngày
Xem
Tin nổi bật










Vui lòng nhập nội dung bình luận.