- Bầu cử Tổng thống Mỹ 2024
- Nhìn lại Hội nghị Thủ tướng đối thoại với nông dân 2023
- Chủ tịch Hội NDVN- Bộ trưởng TNMT lắng nghe nông dân nói
- Kỷ nguyên mới - Kỷ nguyên vươn mình
- Tháo gỡ điểm nghẽn thể chế
- Kỳ họp thứ 8 Quốc hội khóa XV
- Căng thẳng Triều Tiên - Hàn Quốc đang gia tăng
- Diễn đàn Nông dân quốc gia lần thứ IX - 2024
Chủ đề nóng
- Đăng nhập
- Đăng ký
- ×
Vui lòng đăng nhập hoặc đăng ký để gửi bình luận
Khi nhấn đăng nhập đồng nghĩa với việc bạn đã đồng ý với điều khoản sử dụng của báo Dân Việt
Đăng nhập
Họ và tên
Mật khẩu
Mã xác nhận

Khi nhấn đăng ký đồng nghĩa với việc bạn đã đồng ý với
điều khoản sử dụng của
báo Dân Việt
Đăng ký
Xin chào, !
Bạn đã đăng nhập với email:
Đăng xuất
Bộ Y tế có ý kiến về vụ án VN Pharma
P.V
Thứ tư, ngày 25/10/2017 19:05 PM (GMT+7)
Ngày 25.10, ông Đỗ Văn Đông – Phó Cục trưởng Cục Quản lý Dược (Bộ Y tế) đã chia sẻ thông tin về vụ án “Buôn lậu, làm giả con dấu, tài liệu của cơ quan, tổ chức xảy ra tại Công ty Cổ phần VN Pharma”.
Bình luận
0
Theo đó, Bộ Y tế đã trả lời một số câu hỏi mà Tòa án Nhân dân Cấp cao tại TP. Hồ Chí Minh trong phiên xét xử phúc thẩm ngày 19.10 trong vụ án nêu trên. Cụ thể:
Về việc biên bản thẩm định hồ sơ nhập khẩu thuốc H-Capita thiếu một số chữ ký của chuyên gia, trong đó có 3/10 chuyên gia không ký tên, Cục Quản lý Dược cho rằng: Số lượng chuyên gia tham gia thẩm định hồ sơ nhập khẩu thuốc H-Capita Caplet 500mg như sau: Nhóm thẩm định tính pháp lý có 03/04 chuyên gia tham gia thẩm định; Nhóm thẩm định tiêu chuẩn chất lượng và phương pháp kiểm tra chất lượng có 02/03 chuyên gia tham gia thẩm định; Nhóm thẩm định dược lý, lâm sàng có 02/03 chuyên gia tham gia thẩm định.

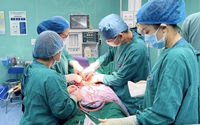
Các bị cáo trong phiên xét xử sơ thẩm vụ án xảy ra tại VN Pharma Ảnh: Quốc Chiến
Theo quy định của Quyết định số 88/QĐ-QLD, việc các trưởng nhóm thẩm định kết luận sau khi có đủ số lượng các chuyên gia thẩm định, ghi ý kiến và ký tên là phù hợp. Việc các đối tượng làm giả hồ sơ như giấy chứng nhận bán tự do (FSC), giấy chứng nhận GMP là rất tinh vi, không thể phát hiện bằng mắt thường. Các giấy tờ này cũng đã được chứng thực sao y bản chính của Phòng Tư pháp Quận 10, TP. Hồ Chí Minh và chỉ được khẳng định là giả sau khi có kết quả giám định của Viện Khoa học hình sự Bộ Công an trong quá trình điều tra.
Lý giải việc “Tại sao Giấy phép hoạt động của Công ty cung cấp thuốc Austin Pharma Specialty Co., Hồng Kông hết hiệu lực vẫn cấp phép nhập khẩu thuốc H-Capita”, Cục Quản lý Dược cho biết: Theo quy định tại khoản 2 Điều 11 Thông tư số 47/2010/TT-BYT ngày 29.12.2010 của Bộ Y tế hướng dẫn hoạt động xuất khẩu, nhập khẩu thuốc và bao bì tiếp xúc trực tiếp với thuốc thì hồ sơ đề nghị cấp phép nhập khẩu đối với thuốc hóa dược không phải là thuốc mới, không phải là thuốc gây nghiện, hướng tâm thần, tiền chất, không cần phải nộp giấy phép hoạt động về thuốc của công ty cung cấp cũng như giấy chứng nhận đủ điều kiện kinh doanh. Công ty nhập khẩu mà chỉ phải xuất trình các giấy tờ này khi làm thủ tục thông quan tại cửa khẩu để chứng minh doanh nghiệp của mình đáp ứng điều kiện quy định.
Về việc quá trình phát hiện lo hàng H-Capita nhập lậu và liệu lô thuốc này đã bán ra thị trường chưa, ông Đông cho biết, quá quá trình kê khai giá thuốc của VN Pharma, Cục Quản lý Dược nhận thấy giá thuốc H-Capita kê khai và giá trúng thầu tại Hội đồng đấu thầu thuốc của Sở Y tế thành phố Hồ Chí Minh thấp hơn các thuốc cùng loại được sản xuất từ các nước thuộc Hệ thống hợp tác về thanh tra trong lĩnh vực thực hành tốt sản xuất thuốc (PIC/s) mà Canada là một thành viên. Vì vậy, Cục Quản lý Dược đã có nghi ngờ về nguồn gốc xuất xứ của thuốc H-Capita và đã mời đại diện Công ty đến làm việc ngày 31.7.2014.
Do giải trình của của Công ty chưa thỏa đáng nên ngày 1.8.2014, Cục Quản lý Dược đã có Công văn số 13134/QLD-KD yêu cầu Công ty tạm ngừng, không tiếp tục nhập khẩu và lưu hành thuốc H-Capita. Như vậy, từ thời điểm ngày 1.8.2014, Cục Quản lý Dược đã có quyết định không cho phép thuốc H-Capita bán ra thị trường.
Đến ngày 14.8.2014, Đoàn kiểm tra với sự tham gia của Viện Kiểm nghiệm thuốc thành phố Hồ Chí Minh đã tiến hành niêm phong toàn bộ số thuốc H-Capita (278.670 viên) có tại Công ty Cổ phần VN Pharma đồng thời tiến hành lấy mẫu kiểm nghiệm tại Viện Kiểm nghiệm thuốc thành phố Hồ Chí Minh để kiểm tra chất lượng.
Sau khi xem xét nhiều thông tin khác, Cục Quản ý Dược - Bộ Y tế đã chuyển toàn bộ thông tin cho Cục A83 - Tổng Cục An ninh II – Bộ Công An để xem xét xử lý theo thẩm quyền.
“Như vậy, Bộ Y tế đã chủ động phát hiện, có các biện pháp ngăn chặn kịp thời, đồng thời chủ động phối hợp với Cơ quan điều tra thông qua việc cung cấp đầy đủ hồ, tài liệu, thông tin đầy đủ, trung thực và hợp tác chặt chẽ, tạo điều kiện thuận lợi tối đa cho công tác điều tra” – ông Đông khẳng định.
Cục Quản lý Dược cũng cho biết, việc cấp giấy phép hoạt động cho công ty Helix Pharmaceuticals Inc đúng quy định và quy trình. Theo đó, việc cấp giấy phép hoạt động cho một công ty nước ngoài hoạt động về thuốc và nguyên liệu làm thuốc tại Việt Nam được thực hiện theo các căn cứ sau: Quyết định số 151/2007/QĐ-TTg ngày 12 tháng 9 năm 2007 của Thủ tướng Chính phủ ban hành quy định về việc nhập khẩu thuốc chưa có số đăng ký tại Việt Nam; Thông tư số 17/2001/BT-TT ngày 01 tháng 8 năm 2001 hướng dẫn doanh nghiệp nước ngoài đăng ký hoạt động về thuốc và nguyên liệu làm thuốc tại Việt Nam; Quyết định thành lập Hội đồng xét duyệt doanh nghiệp nước ngoài đăng ký hoạt động về thuốc tại Việt Nam.
Về quá trình cấp phép 7 thuốc khác của nhà sản xuất Helix Pharmaceutical Inc. Canada của VN Pharma, Cục Quản lý Dược cũng khẳng định, tháng 7, tháng 8 năm 2013, Cục Quản lý Dược nhận hồ sơ đăng ký 07 thuốc được sản xuất bởi Helix Pharmaceutical Inc. Canada sản xuất (H2K Ciprofloxacin 200, H2K Ciprofloxacin 400, H2K Levofloxacin 250, H2K Levofloxacin 500, H2K Levofloxacin 750, H-Cipox 200, H-Levo 500) do Công ty cổ phần VN Pharma nộp.
Sau khi tiếp nhận hồ sơ, các nhóm chuyên gia thẩm định gồm: Pháp chế, Dược lý, Tiêu chuẩn chất lượng, Bào chế (mỗi nhóm có 2 chuyên gia, như vậy mỗi hồ sơ có tổng cộng 8 chuyên gia tham gia quá trình thẩm định) đã tiến hành thẩm định theo quy định… Kết quả thẩm định 7 hồ sơ nêu trên: Tất cả các hồ sơ được thẩm định đạt yêu cầu và được các chuyên gia thẩm định đề xuất cấp số đăng ký.
Tuy nhiên sau đó, ngày 17.9.2014, Cục Lãnh sự - Bộ Ngoại giao có Công văn số 2824/CV-LS-HPH thông báo nội dung, con dấu và người ký có tên là Tham tán Nguyễn Văn Quyền, hợp pháp hóa lãnh sự trên giấy tờ FSC, GMP, ... của thuốc H-Capita do Công ty Helix Pharmaceuticals Inc, Canada sản xuất là không đúng. Vì vậy, Cục Quản lý Dược đã ban hành Quyết định 522/QĐ-QLD về việc rút số đăng ký của 07 thuốc nêu trên và ngừng nhận hồ sơ, không cấp số đăng ký đối với những hồ sơ đã nộp của Công ty cổ phần VN Pharma đăng ký, Công ty Helix Pharmaceutical Inc. Canada sản xuất.
Bộ Y tế khẳng định, theo dữ liệu của Tổng cục Hải quan và kiểm tra của Cục Quản lý Dược, chưa có lô thuốc nào của 07 thuốc trên được nhập khẩu vào Việt Nam. Do đó cũng không có lô thuốc nào được bán trên thị trường.
Sauk hi vụ việc xảy ra, Bộ Y tế đã tiến hành các công việc theo kiến nghị của cơ quan điều tra như sau: Thực hiện việc luân chuyển lãnh đạo và chuyên viên Cục Quản lý Dược, thay thế và bổ sung các chuyên gia thẩm định; Cắt tất cả các danh hiệu thi đua đối với tập thể và cá nhân có liên quan thuộc Phòng Quản lý Kinh doanh Dược - Cục Quản lý Dược; Xử lý hành chính, yêu cầu các cán bộ liên quan và chuyên gia thẩm định báo cáo, giải trình và nghiêm túc kiểm điểm, rút kinh nghiệm sâu sắc; Tập huấn cán bộ, nâng cao chuyên môn, nghiệp vụ cho chuyên gia thuộc tổ thẩm định.
Mời các bạn đồng hành cùng báo Dân Việt trên mạng xã hội Facebook để nhanh chóng cập nhật những tin tức mới và chính xác nhất.
Tin cùng chuyên mục
Xem theo ngày
Xem
Tin nổi bật







Vui lòng nhập nội dung bình luận.