- Bầu cử Tổng thống Mỹ 2024
- Nhìn lại Hội nghị Thủ tướng đối thoại với nông dân 2023
- Chủ tịch Hội NDVN- Bộ trưởng TNMT lắng nghe nông dân nói
- Kỷ nguyên mới - Kỷ nguyên vươn mình
- Tháo gỡ điểm nghẽn thể chế
- Kỳ họp thứ 8 Quốc hội khóa XV
- Căng thẳng Triều Tiên - Hàn Quốc đang gia tăng
- Diễn đàn Nông dân quốc gia lần thứ IX - 2024
Chủ đề nóng
- Đăng nhập
- Đăng ký
- ×
Vui lòng đăng nhập hoặc đăng ký để gửi bình luận
Khi nhấn đăng nhập đồng nghĩa với việc bạn đã đồng ý với điều khoản sử dụng của báo Dân Việt
Đăng nhập
Họ và tên
Mật khẩu
Mã xác nhận

Khi nhấn đăng ký đồng nghĩa với việc bạn đã đồng ý với
điều khoản sử dụng của
báo Dân Việt
Đăng ký
Xin chào, !
Bạn đã đăng nhập với email:
Đăng xuất
Không thiếu thuốc Glivec điều trị cho bệnh nhân ung thư máu
P.V
Thứ tư, ngày 17/01/2018 15:00 PM (GMT+7)
Trước thông tin thiếu thuốc viện trợ Glivec 100mg phục vụ cho công tác điều trị ung thư máu, đại diện Cục Quản lý Dược (Bộ Y tế) khẳng định, đã có phương án để không gián đoạn điều trị cho các bệnh nhân này.
Bình luận
0
TS.Bạch Quốc Khánh- Viện trưởng Viện Huyết học - Truyền máu TW cho biết, hiện tại đang có khoảng 400- 500 bệnh nhân ung thư điều trị bằng thuốc Glivec 100mg và Tasigna 200mg tại Viện Huyết học - Truyền máu T.Ư. HHiện các bệnh nhân này duy trì thuốc Glivec 100mg và Tasigna 200mg điều trị ung thư bằng hai nguồn khác nhau là nguồn viện trợ và nguồn từ Quỹ Bảo hiểm y tế (BHYT). Hiện nay nguồn thuốc viện trợ tạm thời đang hết.
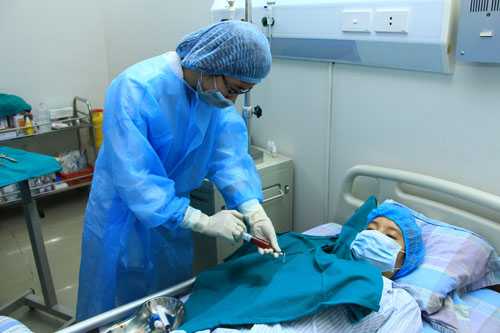
Bệnh nhân điều trị tại Viện Huyết học Truyền máu T.Ư. Ảnh D.L
Tuy nhiên, hiện các bệnh nhân vẫn đang được điều trị bằng nguồn thuốc của Quỹ BHYT. TS Khánh khẳng định không có chuyện bệnh nhân bị "đứt thuốc". TS Khánh cũng cho biết thêm, hiện Viện đã trao đổi với lãnh đạo Bảo hiểm xã hội Việt Nam và Vụ BHYT, Cục Quản lý Dược (Bộ Y tế) để có phương án xử lý điều chỉnh thuốc từ nguồn BHYT sang thuốc viện trợ, nhằm phục vụ nhu cầu điều trị của bệnh nhân. Khi có thuốc viện trợ về, lại chuyển từ nguồn đó sang bù cho thuốc BHYT.
Đại diện Cục Quản lý Dược cho biết, ngày 12.1, Chính phủ đã có Nghị quyết đồng ý cho bốn viện/bệnh viện được tiếp nhận thuốc viện trợ Glivec với hồ sơ nhập khẩu thực hiện theo quy định cũ.

Chính phủ đã đồng ý cho 4 bệnh viện tiếp nhận thuốc viện trợ.
Theo Nghị quyết số 05 của Chính phủ Phó thủ tướng Chính phủ Vũ Đức Đam ký ban hành và gửi hỏa tốc cho các thành viên Chính phủ, Bộ Y tế và các viện/bệnh viện có liên quan, Chính phủ đồng ý cho bốn viện/bệnh viện được tiếp nhận thuốc viện trợ Glivec (Công ty Novartis Pharam Service AG- Thụy Sĩ cung cấp) với hồ sơ nhập khẩu thực hiện theo quy định cũ là quy định tại thông tư 47/2010/TT-BYT của Bộ Y tế (hướng dẫn hoạt động xuất khẩu, nhập khẩu thuốc và bao bì tiếp xúc trực tiếp với thuốc).
Cụ thể, Viện Huyết học - Truyền máu T.Ư được tiếp nhận 247.440 viên (tương đương với 247.440 hộp); Bệnh viện Chợ Rẫy 1.888 hộp, Bệnh viện Ung bướu TP.Hồ Chí Minh 1.603 hộp và Bệnh viện Truyền máu-huyết học TP.Hồ Chí Minh 4.804 hộp.
Phó thủ tưởng cũng yêu cầu Bộ Y tế và bốn viện/bệnh viện nói trên chịu trách nhiệm giám sát quá trình nhập khẩu, kiểm dịch, thử nghiệm chất lượng, thực hiện hậu kiểm lô thuốc; chất lượng, an toàn và hiệu quả của thuốc khi sử dụng.
Cục Quản lý Dược cũng đã có công văn hỏa tốc số 765/QLD-KD đến Sở Y tế TP Hà Nội và TP Hồ Chí Minh và các viện/bệnh viện liên quan (4 viện/bệnh viện trên) đề nghị khẩn trương lập hồ sơ đề nghị nhập khẩu thuốc viện trợ Glivec gửi cơ quan có thẩm quyền, theo quy định tại Thông tư 47 để được xem xét đối với các lô thuốc viện trợ Glivec.
Công văn của Cục Quản lý Dược cũng yêu cầu Sở Y tế hai thành phố trên khẩn trương giải quyết hồ sơ đề nghị nhập khẩu thuốc viện trợ đối với các lô thuốc Glivec; giám sát việc nhập khẩu lô thuốc trên và tiến hành hậu kiểm khi đưa vào sử dụng. Đối với thuóc có hạn dùng còn lại ngắn hơn 12 tháng, Cục Quản lý Dược đồng ý để bệnh viện được tiếp nhận sau khi được Sở Y tế cấp phép nhập khẩu.
Về phía các bệnh viện phải chịu trách nhiệm về chất lượng, an toàn, hiệu quả của thuốc và chỉ đưa vào sử dụng những thuốc còn hạn dùng và đảm bảo chất lượng. Bệnh viện phải có kế hoạch sử dụng và điều chuyển giữa các đơn vị tham gia Chương trình hỗ trợ thuốc Glivec, Tasigna cho người bệnh có thẻ BHYT giai đoạn 2015-2019 đã được Bộ trưởng Bộ Y tế phê duyệt, tránh để thuốc hết hạn sử dụng gây lãng phí.
Mời các bạn đồng hành cùng báo Dân Việt trên mạng xã hội Facebook để nhanh chóng cập nhật những tin tức mới và chính xác nhất.
Tin cùng chuyên mục
Xem theo ngày
Xem
Tin nổi bật







Vui lòng nhập nội dung bình luận.